新技術でわかったハンチントン病のトリプレット伸長と細胞死の関係
アルツハイマー病、パーキンソン病、ハンチントン病を含めた神経変性疾患は、病気の中で最も複雑な病気の一つであり、その原因とメカニズムの解明に多くの研究者が関わってきましたが、依然として議論の対象となっています。
ハンチントン病(HD)は、 自分の意志に反して手足、顔面をピクつかせたり動かしてしまう舞踏運動と認知機能障害、精神症状(幻覚、妄想、抑うつ等)を特徴とする遺伝性、進行性の神経疾患です。その病因遺伝子は4番染色体短腕4p16.3に位置するハンチンチン(huntingtin)タンパク質をコードするHTT遺伝子で、変異ハンチンチン (mHTT) 遺伝子の第1エクソンに存在する「3つの塩基配列CAG」のCAGCAGCAGCAG..という繰り返し配列の数(CAGリピート)が生涯を通じて増加することで、細胞死につながることで引き起こるとされています。CAG配列はグルタミンに翻訳されるため、トリプレット病のうち、ポリグルタミン病、CAGリピート病とも呼ばれる疾患の一つです。
過去30年間蓄積された証拠により、なぜ一部の人で早期に発症するのか、なぜ不随意運動などの症状を引き起こすのかなど、HDのいくつかの重要な特徴を説明するモデルが提出されてきています。しかし、CAGリピートの伸長と細胞死、症状の関係は不明のままです。
ロックフェラー大学のチームが、1月にNature GeneticsとNeuron誌に、蛍光活性化核選別法とシングルセルRNAシーケンシング(シングル核RNAシーケンシング)を利用して、HD患者の基底核の線条体、小脳、大脳皮質から特定の細胞種を分離し、CAGリピートの伸長と細胞死の関係を分析しました。その結果、CAGリピートが伸長しても、その細胞のすべてが細胞死するわけでなく、特定の神経細胞に限定されることがわかりました。
Mätlik, K.et al. (2024) Cell-type-specific CAG repeat expansions and toxicity of mutant Huntingtin in human striatum and cerebellum. Nat Genet https://doi.org/10.1038/s41588-024-01653-6
Pressl, C. et al. Selective vulnerability of layer 5a corticostriatal neurons in Huntington's disease. Neuron. 2024 S0896-6273(23)00968-6.
https://www.cell.com/neuron/fulltext/S0896-6273(23)00968-6
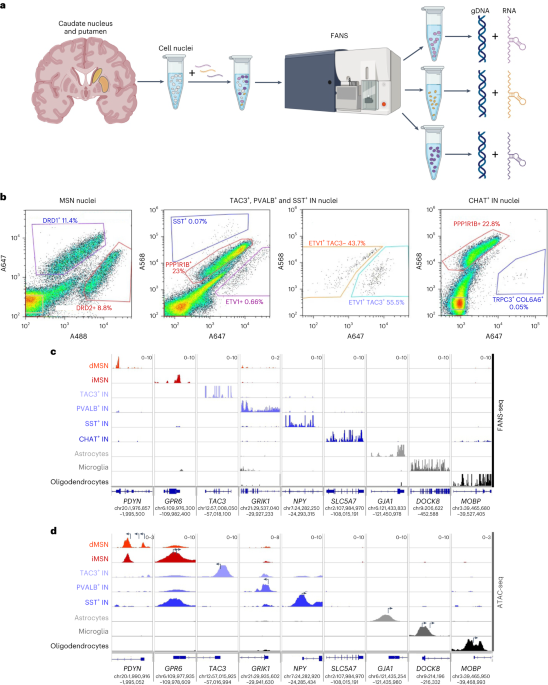
蛍光活性化核選別法(fluorescence-activated nuclear sorting、FANS)とは、核を蛍光抗体法で染色して、その核を選択する方法です。蛍光活性化細胞選別法(FACS)でなく、FANSというのは、核を分離して、それぞれの核にあるRNAのシーケンシングを行うからです。シングルセルRNAシーケンシング(scRNA-seq)は細胞すべてを使いますが、シングル核RNAシーケンシング(snRNA-seq)では核だけを使います。ヒトの患者さんからのサンプルは採集後すぐ凍結し、その凍結試料から核を取り出し、それを染色、FANSで選別していく必要があります。
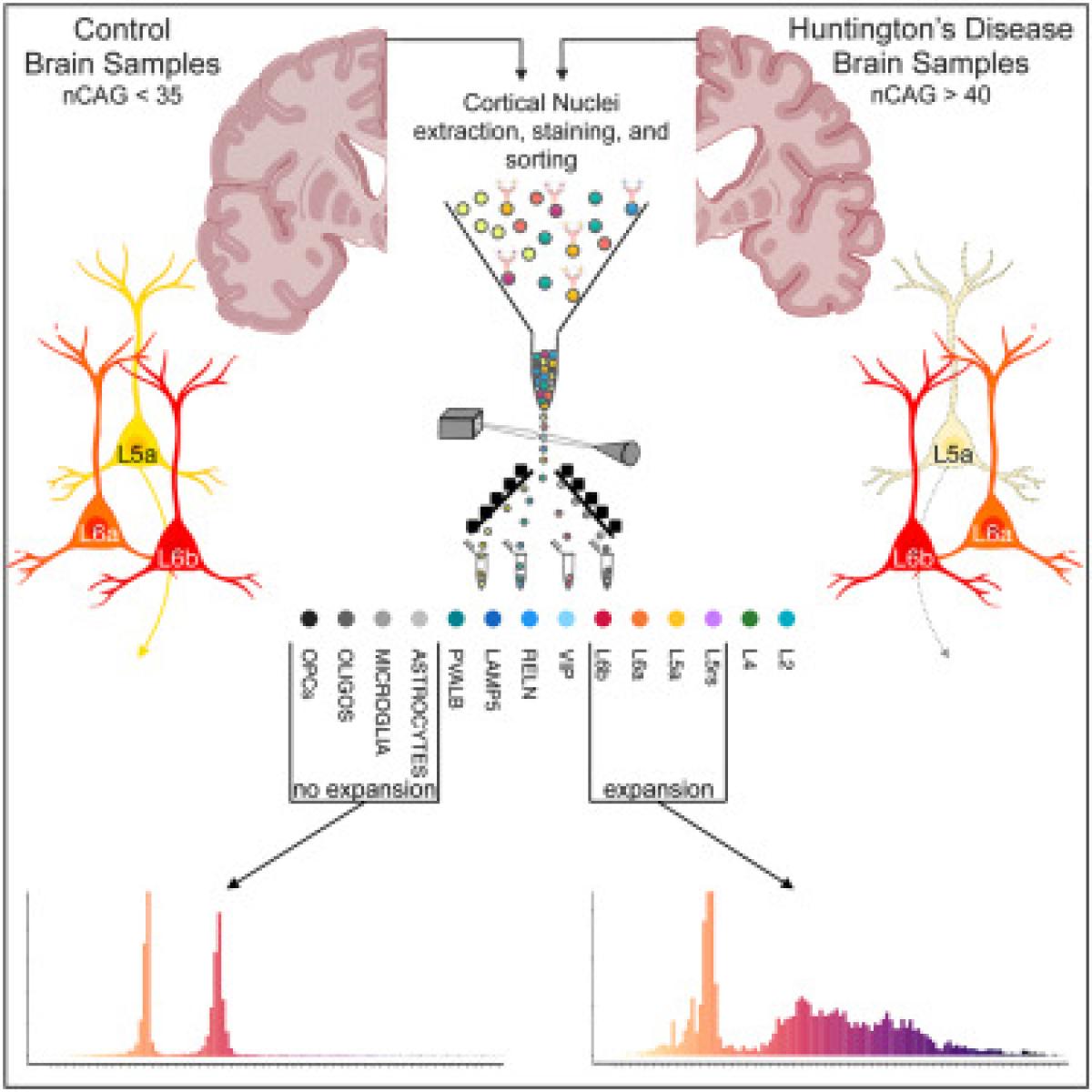
2つの論文の結果をまとめると、CAGリピートの伸長は、HD患者の線条体の中型有棘神経細胞(striatal medium spiny neuron、MSN)、線条体のコリン作動性の介在神経細胞、小脳プルキンエ細胞、大脳皮質の5a層錐体細胞、6a/6b層の神経細胞であるベッツ細胞(Betz細胞)で観察されました。
MSNでのCAG伸長は、MutSβ複合体を形成する DNA修復タンパク質MSH2とMSH3の発現増加と関連していました。細胞分裂において、これらのタンパク質の役割は、ミスマッチ DNA鎖の修復を開始し、がんを引き起こす可能性のある突然変異を防ぐことでゲノムを安定化することと考えられています。しかし、CAGリピートに関しては、これらのタンパク質はCAG伸長を阻止するのではなく促進するようです。MSNは、HDの進行中に線条体から失われることが知られている細胞(線条体で多数を占める線条体外へ線維を送る投射神経細胞)です。一方、同じようにCAG伸長が観察される線条体のコリン作動性の介在神経細胞(線条体では少数で外部には投射しない細胞)は失われません。MSNのみで発現が高いMSH2とMSH3の発現は、CAGリピートの不安定化と細胞死を促進する可能性があります。
5a層錐体細胞は、HDで選択的に脆弱なことが知られていますが、マカクザルの脳を用いた実験で、5a層錐体細胞は皮質から線条体に投射する錐体細胞であることが確認されました。一方、ベッツ細胞は、HDでは耐性があることで知られています。
これらの結果から、5a層錐体細胞とベッツ細胞で見られるCAG伸長は、線条体に投射している5a層錐体細胞でのみHDの神経細胞死につながると考えられます。おそらく皮質に見られるHDで脆弱な5a細胞は、線条体に見られるMSH2とMSH3の発現により脆弱なMSN細胞と関連している可能性があります。
CAGリピートの伸長が必ずしも細胞死につながるわけではないということになります。HDの謎、将来の治療法の標的がおぼろげながら見えてきたような気がします。
【合成生物学ポータル】 https://synbio.hatenablog.jp
【Twitter】 https://twitter.com/yamagatm3
更新の通知を受け取りましょう
























投稿したコメント