ガラクタDNAによる遺伝子発現の制御
かつて、生物学者の大野乾は、So much junk DNA in our genomeのなかで、ゲノム上の機能が特定されていないようなDNA領域のことをjunk DNAと言い、以来その呼称がさまざまな機会に使われるようになりました。一方で機能が現時点ではわからなくても、何らかの機能をしていると仮定することもできます。したがって、ガラクタ、junk DNAと呼ぶのは言い過ぎで、実際、いろいろな機能が提唱されたり、確認されたりしてきています。
ショートタンデムリピート(STR)は、マイクロサテライトまたは単純配列リピートとも呼ばれています。連続的に繰り返される1~6 bpの短いDNA配列であり、最大100 ヌクレオチドの長さになります。原核生物とヒトを含む真核生物に広く見られますが、ヒトゲノムでは、約5%がこれに相当します。ヒトで最も一般的な STRは、A に富んだユニットです(A、AC、AAAN、AAN、および AG)。特にヒトで最も一般的なSTRはジヌクレオチド反復です。STRは、タンパク質をコードする遺伝子では1.5%、ほとんどのSTRは非コーディング領域、特に転写調節領域によく見られるとされます。
そのことから、STRは遺伝子発現に関係していると言われてきました。STRの長さの変化は遺伝子発現の変化と関連しており、統合失調症、がん、自閉症、クローン病などのいくつかの複雑な表現型に関係していると考えられています。 しかし、STR が転写に影響を与えるメカニズムは不明のままです。
そんななか、9月22日のScience誌に、スタンフォード大学を中心とするチームが、STRが転写因子(TF)に結合して真核生物の遺伝子発現を調整しているのではないか、という論文を発表しました[1]。
Horton, C.A. et al. (2023) Short tandem repeats bind transcription factors to tune eukaryotic gene expression. Science. 381(6664):eadd1250. doi: 10.1126/science.add1250.
実際は、5月にbioRxivにプレプリントとして掲示されています。筆頭著者のHorton氏は、現在、カリフォルニア大学バークレー校の大学院生だということです。
この研究では、ハイスループットのマイクロ流路結合アッセイを用いて、STRが、TFタンパク質のDNA結合ドメインに直接結合すること、また、TFが好むSTRが既知の結合部位に似ている必要がないことを示しています。
609個の異なるTF-DNA の組み合わせについて結合定数を測定したところ、異なる STR によって結合親和性が70 倍を超えて変化することがあるということです。特に、CACGTG E-boxをコンセンサスモチーフとして結合する酵母のTFであるPho4とヒトTFのMAXについて、本来のコンセンサスモチーフを変異させた場合に生じる結果に相当するか、それを超えていることが明らかになりました。
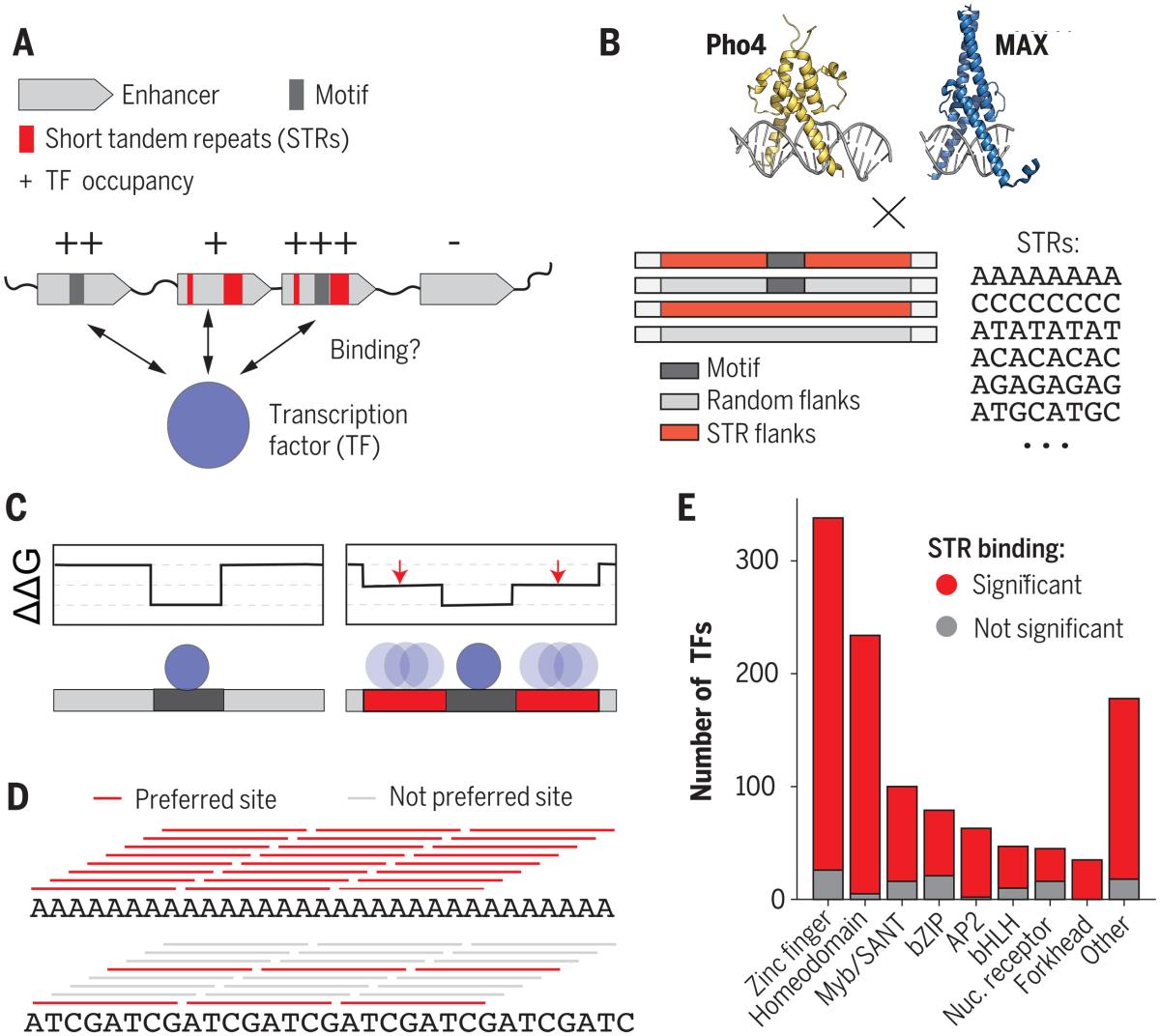
この結合は、低親和性の結合配列が繰り返され相加的に働くことで、大きな効果をもたらす単純なモデルによって説明および予測できます。 これらの発見は、STRがTF結合下流の遺伝子発現のレベルを制御することを明確に示しています。
STRが特定の病気のリスクの増加または減少に関連していることがこれまで知られてきましたが、このような理解にこの研究は役立つと思われます。
STRは、遺伝子を扱う際に、プライマーのデザインに厄介なので、つい避けてしまうのですが、考えさせる研究だと思います。
[1] Horton, C.A. et al. (2023) Short tandem repeats bind transcription factors to tune eukaryotic gene expression. Science. 381(6664):eadd1250. doi: 10.1126/science.add1250.
【Twitter】 https://twitter.com/yamagatm3
更新の通知を受け取りましょう


























投稿したコメント