希少疾患「ドラッグロス」拡大 欧米ベンチャーと連携不足
コメント
注目のコメント
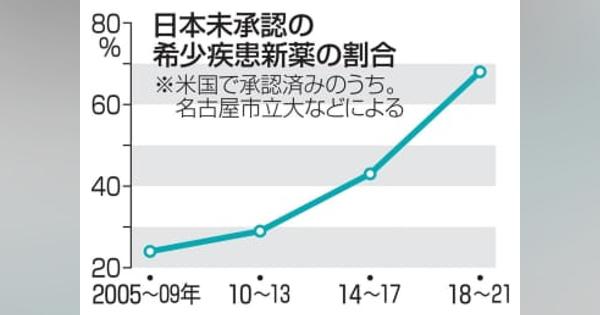
資料に示されているように、希少疾患治療薬が日本を素通りしている傾向は年々強くなっていますが、記事に書かれているような、欧米ベンチャーと連携が不足するというような単純な話ではありません。わかりながら日本を避けているわけですから、問題はより根深いはずです。
医薬品として開発するために行う臨床試験は、臨床試験のバイアスを防ぎ、臨床試験の科学性と倫理性を担保するために、実施前に国際機関に登録・公開します。その後、臨床試験を行い、「好結果・期待外れ」を問わず、すべての結果が公開されます。(臨床試験登録制度)
臨床試験登録がされると、全世界の企業が知るところになることから、少なくとも「情報公開不足」ということはありません。情報が出れば、日本の企業と米国の臨床試験実施元企業(ベンチャー企業等)はコンタクトを取りあいます。つまり、日本のドラッグラグは、「日本市場は魅力的でないため、日本で早期に市場導入したいと考える企業が限定される」ことが理由と思われます。
その主な原因を2つあげます。第1に日本で薬事承認がされ保険適用になると、政府が価格を決めますが、日本の場合、大多数の健康保険の支払者が政府自身であるため、米国などとくらべて安い薬価がつきます。
米国は、製薬企業が希望価格で値段をつけるため、他に医薬品が存在しない希少疾患の場合は、患者数の少なさを考慮して企業が高価格をつけます。年間治療費数百万~数千万円の価格がつけられることは珍しくありません。
日本の薬価制度は、外国での医薬品価格があればそれを参考し、それ以下の価格が政府によりつけられることが多いため、自由価格国で先行発売し、日本市場での販売は機が熟すまで待った方が、営利企業のビジネスとしては、都合が良いことになります。
第2に、日本の臨床試験環境の劣悪さがあげられます。日本で臨床試験を実施を企画しても、世界の各国と比べて国民の理解が得られず、ほとんど患者が集まらない現状があります。例えば、新型コロナワクチンの臨床試験のケースでは、国際臨床試験で、日本も同じタイミングで臨床試験に加わりましたが、世界で4万例集めたペース中、日本は数十例を集められたにすぎませんでした。
これまでは、人種差の確認や海外データの信頼性検証のために、政府は日本国内での試験を求めていたため、第2の理由のクリアが難しかったわけです。日本で薬剤承認を受けるためには、日本人が含まれた治験で、安全性と有効性を確認しなければならないという古臭い仕組みが残っています。そのため、海外で行われた治験で日本人が含まれていない場合、日本人を対象とした臨床試験を行わなければならなくなります。どちらかというとこれが大変で、ニーズと天秤にかけて行われない可能性の方が高いように思います。
この仕組みを大幅に緩和する方向に厚生労働省も動いており、ゆっくりと良い方向に向かっているように思います。日本では健康保険により自己負担が医療費の1~3割(高額医療費制度により上限以上は自己負担なし)となっています
そのため高額な医薬品は医療費の増加(保険料や税金の増加)を招くとして問題になったことがあります(興味があればオプジーボを調べてください)
その状況で新しい薬にお金をかけたいと思うでしょうか?
単純にそういう話だと考えています
