東北大学は2021年4月6日、Ca(カルシウム)イオンをキャリアに用いるCaイオン電池の新しい電解質を開発したと発表した。新電解質は、Caイオンの伝導率が高く、電極に対する電気化学的安定性も高いという特長を持つ。この電解質を用いて、負極にCa金属、正極にS(硫黄)を使ったセルで充放電試験を実施したところ、Caの安定した溶解析出を確認したとする。「これまでのCaイオン電池開発の課題を解決する技術」(東北大学)であり、今後Caイオン電池の開発が加速していく可能性がある。
Caイオン電池は、「負極にCa金属、正極にSを用いれば、約1000Wh/kgの理論重量エネルギー密度が見込める」(東北大学 材料科学高等研究所 助教 木須一彰氏)という、高いポテンシャルを持った次世代電池である。しかし、これまで電解質に課題があった。既存の電解質はF(フッ素)を含むが、動作時にフッ化カルシウムなどの分解生成物が生じたり、キャリアの伝導率や電気化学的安定性が低かったりという課題があった。
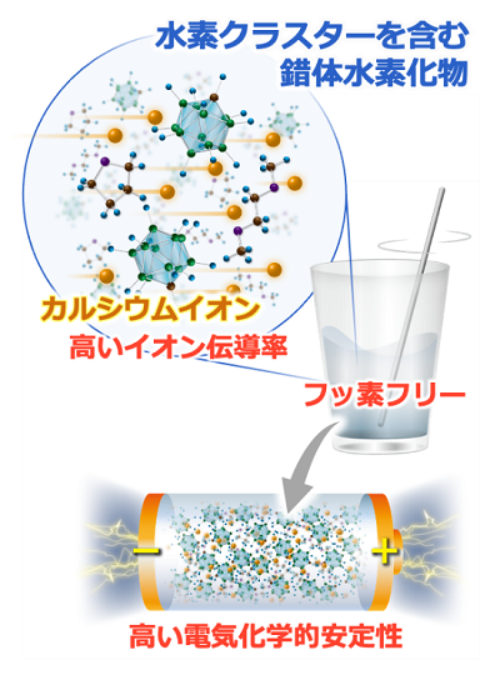
新しい電解質はFを含まない。Ca塩のCa[CB11H12]2を、ジメトキシエタン(DME)やテトラヒドロフラン(THF)といった一般的な有機溶媒に溶解して使う。錯イオンの[CB11H12]-は、1個のC(炭素)と11個のB(ホウ素)を中心原子として、12個のH(水素)が結合する「水素クラスター」という分子構造を持つ。
今回の電解質でCaイオンの伝導率が向上した要因は2つある。1つは、Ca[CB11H12]2がDMEとTHFの2種類を混ぜた混合溶媒に多く溶解するため。DME単体やTHF単体の溶媒と比べて、約200倍溶解する。電解質内のCaイオンの濃度が向上したことで、伝導率が増加した。2つめのファクターは、錯イオン[CB11H12]-のCaイオンに対する相互作用が弱い(弱配位性)ため。アニオンとカチオンの相互作用が強いと、「イオンペア」という状態をつくり、電解質内をキャリアが移動しにくくなってしまうが、新電解質ではそれが起こらない。
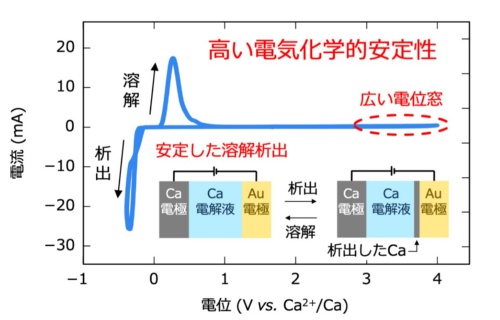
イオン伝導率に加えて電気化学的安定性も向上した。Ca[CB11H12]2は4V(vs Ca2+/Ca)の広い電位窓を持つため、電解質が充放電時に酸化還元反応を起こしにくい。したがって電池の安定動作が可能になる。

![Ca[CB<sub>11</sub>H<sub>12</sub>]<sub>2</sub>の伝導率と温度の関係](https://cdn-xtech.nikkei.com/atcl/nxt/column/18/00001/05451/zu01.jpg?__scale=w:500,h:510&_sh=07b0e60203)